美国FDA于今年5月1日经过1天的审评即批准吉利德公司的抗病毒药物瑞德西韦用于新冠肺炎COVID-19感染患者的紧急使用。而在日本,经过了7天时间瑞德西韦才获得行政许可。10月3日,感染新冠肺炎的美国总统特朗普刚一到达美国Walter Reed医院便注射了瑞德西韦。
那么,瑞德西韦是怎样被发现的呢?
这要追溯到第一个抗病毒药物碘苷(idoxuridine)的发现。
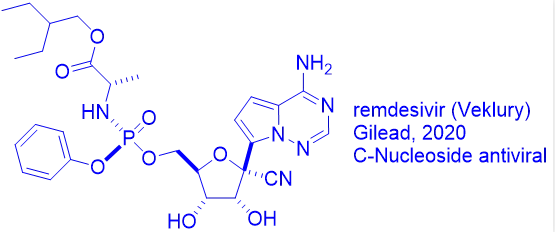
1988年诺贝尔生理学和医学奖得主George H. Hitchings开始对嘌呤和嘧啶类似物作为潜在药物进行系统考察。受到他的启发,耶鲁大学的William H. Prusoff教授于1959年首次发现了第一个小分子抗病毒药物-碘苷(IdU)。Prusoff教授也因此被奉为现代抗病毒化疗药物的教父。
尽管碘苷的毒性太大,无法全身给药,但它适合局部用于治疗单纯疱疹病毒引起的眼睛和皮肤感染。虽然碘苷的抗病毒机制仍不明确,但最有可能首先在病毒和正常细胞中被激酶磷酸化成为相应的核苷酸单磷酸(当磷酸连接到核苷时,它就变成了核苷酸),核苷二磷酸(NDP)和核苷三磷酸(NTP)形式。NTP是具有两种作用活性药物。
首先,它能够与病毒DNA聚合酶相互作用,造成病毒DNA复制终止,从而发挥抗病毒活性;另外,它也可能作用于宿主细胞DNA聚合酶,导致细胞毒性、线粒体毒性和抗肿瘤活性。
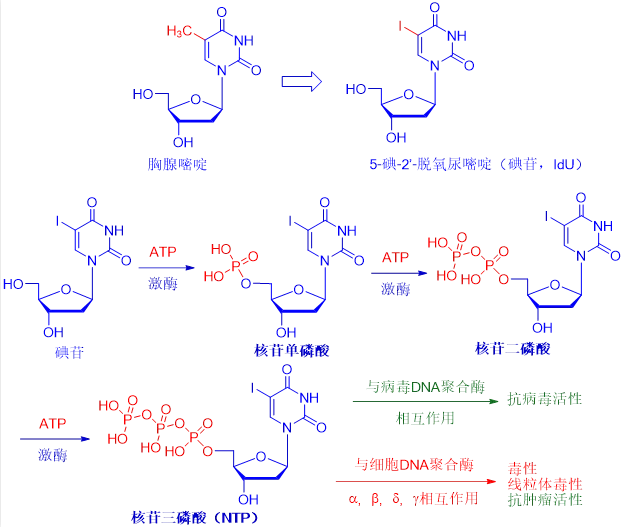
碘苷的出现开启了核糖核苷类抗病毒药物发现的闸门。随后出现了三氟胸苷(trifluorothymidine,TFT, Viroptic)、乙基脱氧尿嘧啶(EdU)、溴乙烯脱氧尿嘧啶(BVDU)、和最近发现的替比夫定(telbivudine, Tyzeka),替比夫定是诺华公司2006年上市的合成胸腺嘧啶核苷类似物。
与George Hitchings共同分享1988年诺贝尔奖的Gertrude “Trudy” Elion率领的卫康研究所(Wellcome Research Institute)团队曾经发现了治疗单纯疱疹病毒感染的阿昔洛韦(acyclovir, Zovirax)。当时,Wellcome公司化学家Howard Schaeffer发现核糖核苷药物中的完整糖环(如鸟苷)对于与DNA合成所需的酶结合并非必需,并通过去掉五元糖环中的二醇片段而得到了阿昔洛韦。其后来成为当时抗病毒药物最成功典范之一,证明科学家的创造力永无止境!

随着阿昔洛韦的发现,它的类似药物更昔洛韦(Cytovene,1988)和喷昔洛韦(Denavir,1996)也随之出现。
在上世纪八十年代早期,艾滋病曾因为无药可治被认为是绝症。而核苷类抗病毒药物的出现则为艾滋病人的生命换来了时间。1984年美国国立癌症研究所NCI汇集多家重磅医药公司启动了一项旨在发现潜在药物候选物的筛选工作。但是只有一个化合物显示出阻止HIV病毒逆转录酶活性的效应,它就是由韦恩州立大学的Jerome Horowitz首次合成,被Burroughs Wellcome公司申请注册的齐多夫定(Zidovudine, AZT)。
如下图所示,齐多夫定与胸腺嘧啶结构中的唯一区别是胸腺嘧啶的羟基被叠氮基团替换。就作用机理(MoA)而言,齐多夫定在激酶磷酸化后能够伪装成胸腺嘧啶三磷酸被逆转录酶整合进入病毒DNA。当它出现在DNA链延长的末端时,导致延长终止。因此,这也是与齐多夫定类似的核苷类抗病毒剂被称为链终止剂的原因。
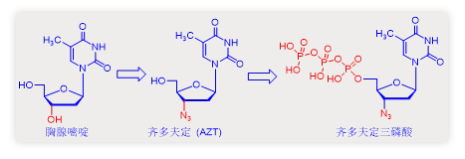
齐多夫定也显示出了一定的选择性。齐多夫定三磷酸抑制逆转录酶合成DNA的能力比抑制细胞核中宿主细胞DNA聚合酶合成DNA的能力高约100倍。
更可喜的是,AZT抑制HIV复制的活性浓度比其抑制宿主淋巴细胞复制的浓度低约一千倍。也就是说,与正常健康细胞相比,AZT对病毒具有更快杀伤作用,提供了治疗窗。正如希波克拉底誓言所倡导的:首先保证无毒性。
尽管瑞德西韦治疗新冠肺炎的药效并不非常优越,美国人的英雄安东尼福奇(Anthony Fauci)博士也曾将瑞德西韦之于新冠肺炎比作是AZT的发现对于HIV的贡献。在AZT发现之后,许多“me-too”和“me-better”的核苷类逆转录酶抑制剂(NRTIs)逐渐上市。其中包括d4t(Zerit)、ddI(Videx)、艾莫里大学的Dennis Liotta发现的拉米夫定(3TC, Epivir)、明尼苏达的Bob Vince和GSK共同研发的阿巴卡韦(Ziagen)。
同时,许多非核苷类逆转录酶抑制剂(NNRTIs)也陆续被发现,包括奈韦拉平(Viramune)、依法韦伦(Sustiva)、地拉夫定(Rescriptor)、依曲韦林(Intelence)和利匹韦林(商品名:Edurant)。除此之外,许多HIV蛋白酶抑制剂,如沙奎那韦(Invirase)、茚地那韦(Crixivan)、利托那韦(Norvir)、替拉那韦(Aptivius)和达芦那韦(Prezista)也被发现。1996年,高活性抗逆转录病毒疗法(HAART),也称作鸡尾酒疗法,将艾滋病从公认的绝症转变为一种能够通过药物控制(接近治愈)的慢性疾病。我们希望同样的成果能够很快出现用于新冠肺炎的治疗。
HCV药物奠定了瑞德西韦发现的基础。丙型肝炎病毒(HCV)代表了一个现代医药界的标志性胜利。与甲肝(HAV)和乙肝(HBV)不同,有一些HCV感染患者根本没有症状,这也解释了为什么直到1989年全球已经有两亿人感染了HCV,这个病毒才被克隆成功。
单纯疱疹病毒和HIV都是DNA病毒,与之不同,HCV是一种单链RNA病毒。编码HCV基因组的蛋白包括多个非结构(non-structure,NS)蛋白。其中一个是NS5B蛋白,也叫作RNA依赖的RNA聚合酶(RdRp,瑞德西韦同样是抑制冠状病毒的RdRp),这是病毒基因组最脆弱的环节,是病毒在宿主内复制最易受影响的节点。与其他非结构蛋白如NS3/4A和NS5A一样,HCV NS5B也在病毒基因组复制过程中发挥重要作用,因此代表一类重要和可控的药物研发设计靶点。
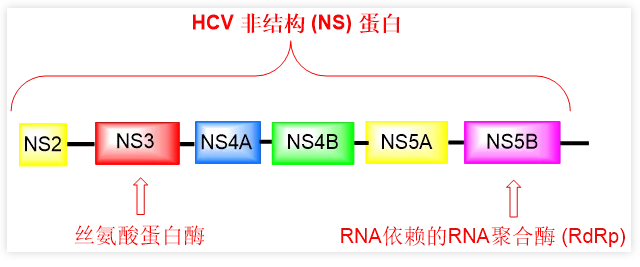
HCV NS5B抑制剂类的一个明星药物是索非布韦(商品名:Sovaldi),其最初由Pharmasset公司发现,后被吉利德公司销售。1 索非布韦曾经因为一片一千美元的价格被全美关注!但在当时没有药物能够治愈HCV的时候,索非布韦成功治愈了HCV,证明了这个价格相比其他药物仍然具有更好的药物经济学。
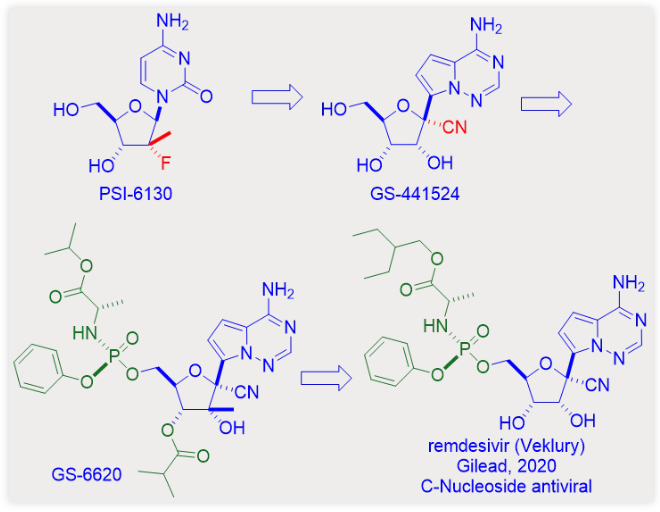
索非布韦是新型核苷PSI-6130的前药,PSI-6130核糖环2’-位是一个较为少见的含氟叔碳,因此其本身就令人称奇这个化合物也证实了氟原子在现代药物发现中的重要性。在1955年氟可的松被发现之前,还没有任何含氟的药物存在,但如今已经有超过20%的药物分子含有一个或更多个氟原子。
从有记录以来至今,含氟原子最多(七个)的药物是2003年由默克公司注册上市的阿瑞吡坦(商品名:Emend),该药物是P物质拮抗剂和神经激肽1(NK1)受体拮抗剂,用于缓解化疗引起呕吐。

索非布韦明显优于PSI-6130的一个重要方面在于它是PSI-6130的前药形式。当我们读任何一本药物化学的书籍,会发现前药形式总能够将一个糟糕的药物转变为一个很好的药物。
前药的诸多优势包括:
(a)能够克服剂型和给药缺陷
(b)克服吸收障碍
(c)解决分布难题
(d)改善代谢和排泄
(e)降低毒性
因此,前药占据了目前5%的已知药物和更大比例的新药。
索非布韦并不只是一个简单的前药,而是最新型的磷酰胺酯前药。那些核苷酸的前药被称为ProTides。这项技术是由威尔士卡迪夫大学的Chris McGuigan教授与1990年发展建立的。它也是在抗病毒药物领域应用最为成功的前药策略。
要将PSI-6130转变为活性的三磷酸形式,PSI-6130需要首先被磷酸化为5’-单磷酸形式。然而,由于这种情况经常发生,该病毒要么不诱导特异性激酶,要么通过该酶的突变对化合物产生抗药性,而人类细胞则无法确保其磷酸化。
而解决这个问题最好的办法就是直接在核苷结构中构建一个磷酸盐,从而成为核苷酸。遗憾的是,磷酸盐在生理pH条件下带有负电荷,导致相应的核苷酸均表现为非常差的细胞膜透过性。在克服极性问题的许多策略中,最成功的就是ProTide。
ProTide的核苷酸被一个通过P-N键连接的氨基酸酯前体所掩盖。较为常用的氨基酸是L-丙氨酸,索非布韦也是如此。这样的ProTides能够通过被动扩散穿过细胞膜进入细胞。一旦进入细胞,核苷单磷酸就能被释放出来,继续发挥病毒RNA复制终止剂的作用。索非布韦就是这样一个能够口服给药的成功药物实例。
多种因素如众星捧月般共同成就了一个药效强、口服吸收好的药物索非布韦。这也是吉利德公司斥资110亿美元从Pharmasset公司将其收购的原因。尽管当时华尔街大喊它的价格过高,但吉利德仍然领先,因为从科学上来说索非布韦是一次胜利,在财务上是一笔意外之财。
同时,吉利德也开始研发自己的HCV NS5B药物,其中一个就是核苷药物GS-44154。吉利德的GS-44154与Pharmasset的PSI-6130有两点不同:首先,前者的核糖环1’-位是含有氰基取代的叔碳;其次,与后者的天然N-核苷不同,前者与核糖1’-位连接的是非天然的C-核苷碱基。因此,GS-44154是一个1’-氰基取代的C-核苷核糖类似物。
无论从理论还是实际应用将,C-苷更能耐受人体代谢。2012年吉利德公司在细胞模型上评价了GS-44154对一系列RNA病毒的影响,结果发现其具有广谱抗病毒活性,GS-44154对HCV、登革病毒2、甲型流感病毒和SARS病毒等均具有抑制活性。2 SARS病毒代表严重急性呼吸综合征冠状病毒,其在结构上与目前流行的COVID-19病原体SARS-CoV-2结构近似。
包括GS-44154在内的大多数核苷都存在膜透过性低的缺陷,因此在基于细胞模型的抗病毒剂筛选过程中命中率很低。前药经常被用来提高核苷药物的细胞膜通透性。通过构建GS-44154的磷酰胺酯前药,吉利德得到了自己的HCV NS5B抑制剂GS-6620。它也是第一个在HCV感染者体内产生抗病毒反应的C-苷类HCV聚合酶抑制剂。3 但是随着索非布韦取得巨大的成功,吉利德自己不再需要另一个类似药物,因此,自产的GS-6620被封存在吉利德化合物库中。
随后,另一个丝状病毒科成员埃博拉病毒(EBOV)爆发。EBOV是一种单股负链非片段RNA病毒。在近10年间,西非有超过28000例埃博拉病毒感染者被确诊。为了抗击埃博拉全球流行,吉利德公司与美国疾病预防与控制中心(CDC)、以及美国陆军传染病医学研究所(USAMRIID)开展了合作。他们筛选了大约1000个化合物,其中大部分是吉利德公司的核苷和核苷酸类化合物。
鉴于RNA病毒囊括了多数新发的病毒感染,从冠状病毒科的呼吸道病原体如严重急性呼吸综合征(SARS)病毒和中东呼吸综合征(MERS)病毒到丝状病毒科的蚊媒病毒如登革病毒和寨卡病毒,均属于RNA病毒。因此,他们更关注能够靶向RNA病毒的核糖核苷类似物。
结果,从一千种化合物中筛选出的阳性化合物为GS-44154及其单磷酸形式的相应磷酰胺酯前药。该前药是Sp型异构体GS-5734,其在后续开发中被命名为瑞德西韦和Veklury。4 正如药物化学家所理解的,化学结构中的微小改变都可能导致理化性质和药学性质的巨大改变。尽管瑞德西韦和索非布韦结构非常近似,但是瑞德西韦只能通过静脉注射给药,而索非布韦则是口服可以吸收的。
在2012年的一项研究中,GS-573(瑞德西韦)对SARS病毒Toronto 2号病毒株显示出抗病毒活性,而且没有对宿主细胞产生细胞毒性。2016年瑞德西韦又被证实在恒河猴动物模型上显示出体内抗埃博拉病毒活性。5 由于该药物可用于非人类灵长类动物,就会被认为其足够安全、有效的用于人类进行临床试验。
当时共有4个药物开展了治疗埃博拉病毒疾病的临床试验,它们分别是:Mapp生物医药公司的ZMapp、NIH疫苗研究中心的单克隆抗体mAb114、再生元的REGN-EB3和吉利德公司的瑞德西韦。除了瑞德西韦是小分子药物外,另外3个单克隆抗体药物。单克隆抗体衍生自与特定物质(例如入侵病毒)结合的免疫系统分子。很快,ZMapp和瑞德西韦就因为阻止患者死亡的有效性低于mAb114和REGN-EB3而被提前终止。最后,在肆虐非洲许多年后埃博拉病毒流行也逐渐被控制住了。
2019年底,COVID-19出现在中国武汉。就致病力而言,COVID-19是冠状病毒之最。如同埃博拉病毒,COVID-19也是一种RNA病毒。吉利德的科学家并没有花费太多时间,很快就确定了瑞德西韦用于COVID-19的治疗潜力。
首先,瑞德西韦在体外通过抑制RNA依赖的RNA聚合酶活性,发挥出对病原性动物(恒河猴)冠状病毒和人冠状病毒(包括COVID-19病原体SARS-CoV-2在内)的明显的抑制效果。它也能够抑制SARS和MERS冠状病毒。
更为讽刺的是,瑞德西韦的汉语发音听起来像 “人民的希望”。在最初全球大流行黑暗时期,瑞德西韦曾经是人民唯一的希望。
尽管瑞德西韦在中国临床研究的结果并不明朗,美国国家过敏和感染性疾病研究所(NIAID)的福奇博士团队使用临床试验的金标准-随机双盲临床试验,发现瑞德西韦治疗COVID-19具有统计学差异的受益结果。就如他们所说,剩下的都是历史。
如果这次的COVID-19全球大流行还有一线希望的话,我希望是让人们重新认识到科学和医学的重要。新一代的年轻人能将科学、技术、工程与数学(STEM)或医学作为职业选择来挽救更多人的生命,而不是更愿意从事赚钱的行业。我们会创造真正的药物来治愈疾病,而不是通过喝消毒剂来杀死病毒。
关键词:瑞德西韦
分享至:
![]()
![]()




鄂公网安备 42011102004299号
© 2014-2024 前衍化学科技(武汉)有限公司 版权所有 鄂ICP备20009754号-1