 14726
来源:有机化学网
2020-10-28
14726
来源:有机化学网
2020-10-28
【英文名称】Triphenylphine
【分子式】C18H15P
【分子量】262.29
【CAS】603-35-0
【物理性质】白色晶体,bp337°C/1.0 mmHg (133.322 Pa), mp 79-81°C, d 1.18g/cm3,溶于大多数有机溶剂,易溶于乙醇,苯,氯仿。极易溶于乙醚,但不溶于水。
【制备和商品】国内外试剂公司均有销售。可以从正己坑、甲醇或95%乙醇中重结晶,在65°C/1.0 mmHg (133.322 Pa)下经过CaSO4或P2O5干燥后可得到纯净固体。
【注意事项】在剧烈暴晒下会刺激人体,长时间接触有神经毒性。芳基膦与氧的反应活性比苄基和烷基膦低,但是空气对于三苯基膦的氧化非常明显,生成三苯基膦氧化物。三苯基膦不易着火和爆炸,但在加热分解时会生成有毒的磷化氢和POx烟雾。
三苯基膦是一种相当常用的还原剂。在大多数情况下,反应都是由生成三苯基膦氧化物(一个热力学有利的反应)驱动的。另外,三苯基膦广泛用作金属催化剂的配体。
脱氧反应 三苯基膦广泛地应用于过氧化氢或过氧化物的还原反应,生成醇、羰基化合物或环氧化物。这类反应的主要驱动力是三苯基膦与相对较弱的O-O键(188-209 kJ/mol)能形成较强的P=O键。例如:利用三苯基膦可以还原分解臭氧化物、选择性制备酮和醛(式1)[1]。
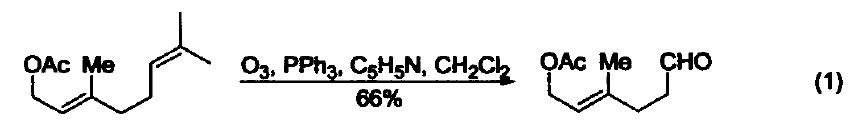
与叠氮化物的反应 三苯基膦与有机叠氮化合物反应生成亚氨基膦烷(式2)[2]。
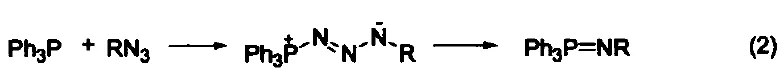
亚氨基膦烷是一种较活泼的亲核试剂,易与亲电试剂反应。例如:与醛和酮反应生成亚胺和三苯基膦氧化物。这个反应与 Wittig 反应相似,称作aza-Wittig反应,这个反应的驱动力也是由于三苯基氧膦的生成(式3)[3]
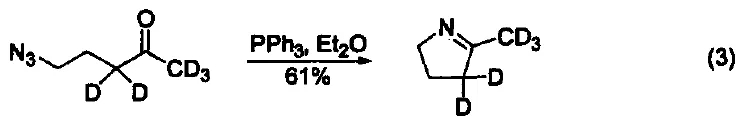
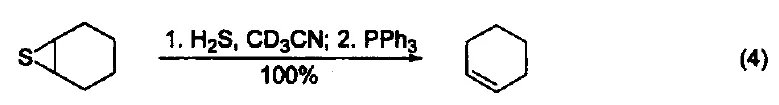
与有机硫化物的反应 在室温下,三苯基膦可以将环硫化合物转变成为烯烃(式4)[4]。
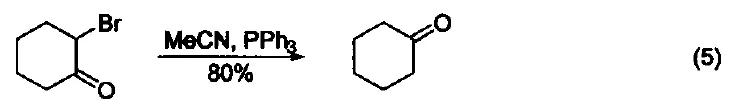
脱卤反应 α-溴代酮与三苯基膦反应生成酮(式5)[5]。
与有机环氧化物的反应 在水和丙酮溶剂中回流,三苯基膦可以将环氧化合物在叠氮化钠参与下转变为环胺化合物(式6)[6]。
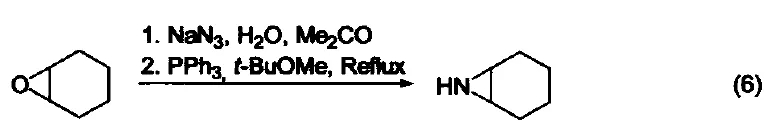
取代吡咯的制备 苯胺、呋喃二酮与三苯基膦反应生成1-苯基-2,5-吡咯二酮(式7)[7]。
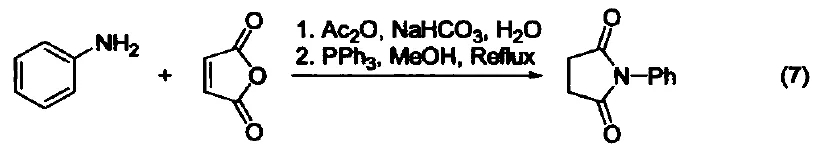
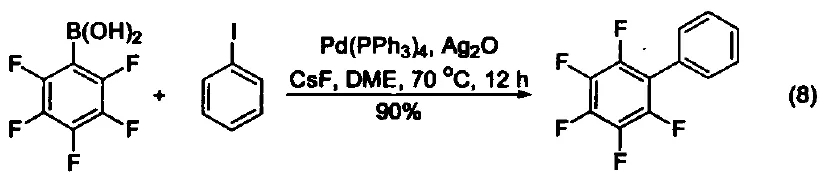
用作金属催化剂的配体 三苯基膦可以作为配体与许多过渡金属组成金属催化剂。例如:Pd(PPh3)4就是一种重要的催化剂[8],常用于催化偶联反应。这些偶联反应是构建碳-碳键的重要方法,其特点是催化条件温和。又例如:在 Pd(PPh3)4 和Ag2O的共同作用下,苯硼酸与芳香卤代烃直接反应生成联苯类化合物,该反应的产率可达 90 % ( 式8)[9,10]。除了苯硼酸和卤代物以外,镁试剂[11]、锌试剂[12]、锡试剂[13]、硅化合物[14]等均可作为偶联反应的底物。
参考文献
1. Trost, B. M.; Machacek,M. R.; Tsui, H. C.J. Am. Chem. Soc. 2005,127, 7014.
2. Gololobov, Y. G.; 23imurova, I. N.; Kasukhin, L. F. Tetrahedron 1981,37,437.
3. Jean-Louis, C.; Jean-Pierre, F.; Claudine, F.; Paul, T. Org. Bioorg. Chem. 2003,1, 1591.
4. Josemon, J.; James, H. E. Chem. Commun. 1999,1003.
5. Naoshi, K.; Hiroshi, T.; Yasutaka, I. Chem. Lett. 1992,293.
6. Dalili, S.; Yudin, A. K. Org. Lett. 2005, 7, 1161.
7. Pal, B.; Pradhan, P. K.; Jaisankar, P.; Giri, V. S. Synthesis 2003,10, 1549.
8. 综述文献见:(a) Suzuki, A. J. Org. Chem. 1999, 64, 147. (b) Jwanro, H.; Marc, S.; Christel, G.;
Emmanuelle, S.; Marc, L. Chem. Rev. 2002,102,1359.
9. Korenaga, T.; Kosaki, T.; Fukumura, R.; Ema, T.; Sakai, T. Org. Lett. 2005, 7,4915.
10. Flaherty, A.; Trunkfield, A.; Barton, W. Org. Lett. 2005, 7,4975.
11. Uemura, M.; Takayama, Y.; Sato, F. Org. Lett. 2004, 6,5001.
12. Pei, J.;Ni, J.; Zhou, X.-H.; Cao, X.-Y.; Lai, Y.-H. J. Org. Chem. 2002, 67,4924.
13. Shirakawa, E.; Yoshida, H.; Nakao, Y.; Hiyama, T. J. Am. Chem. Soc. 1999,121,4290.
14. Mowery, M. E.; DeShong, P. J. Org. Chem. 1999, 64, 1684.
