目前,发端于湖北武汉的新型冠状病毒肺炎疫情正在加快蔓延,形势异常严峻。
一向用产品说话的百新意生物科技,于疫情开始就紧急召集公司精锐力量,于两周内密集完成了如下2019-nCoV重组蛋白产品的研发,部分原料已开始量产和销售,全线产品已开始接受咨询与预订。百新意拥有国际一流的抗体与蛋白质工程技术,我们保证抗原质量可靠,抗体万里挑一!关于百新意的抗体优化能力,可参见百新意大讲堂系列文章《抗体优化漫谈》、《人源化》、《亲和力成熟》和《稳定性优化》。关于原料和检测方法的选择,请参考产品列表后的内容。
武汉挺住,兄弟们加油!
原料与方法学的选择
冠状病毒可引起动物和人类的呼吸道和肠道感染。它们曾经不被认为对人类具有高致病性,直到2002年和2003年在中国广东爆发了严重急性呼吸综合征(SARS)。SARS发生十年后,另一种高致病性冠状病毒中东呼吸综合征冠状病毒(MERS-CoV)出现在中东国家。SARS冠状病毒(SARS-CoV)利用血管紧张素转化酶2(ACE2:angiotensin-convertingenzyme2)作为受体并主要感染有纤毛的支气管上皮细胞和II型肺泡壁细胞,而MERS-CoV利用二肽基肽酶4(DPP4:dipeptidylpeptidase4,也称为CD26)作为受体感染无纤毛的支气管上皮细胞和II型肺泡壁细胞。SARS冠状病毒和MERS冠状病毒分别从果子狸和单峰骆驼传染给人类,这两种病毒都被认为起源于蝙蝠。
2019年底,我国爆发了新一轮的冠状病毒(2019-nCov)疫情,截止至2020年2月5日,已造成了超过24000人感染。就目前情况而言,该病毒的感染性超过了SARS-Cov,但重症率和致死率尚不如SARS-Cov。目前临床确诊主要采用核酸诊断和CT的结合,确诊速度较慢。众所周知,免疫学方法具有灵敏度高、假阳性低、对检测环境要求不高和检测速度快等优点,因此非常适合快速筛查。
1月24日,权威医学期刊《柳叶刀》发布的“2019武汉新型冠状病毒临床特点”文章中做了细胞因子和趋化因子的测定,结果发现ICU患者和非ICU患者的初始血浆IL-1β,IL-2,IL-6,IL7,IL8,IL9,IL10,GM-CSF,IFN-γ,VEGF,PDGF,和TNFα浓度均高于健康成年人,提示了细胞因子风暴(CRS)的可能。因此,除了2019-nCov相关蛋白和抗体,我们还给出了细胞因子风暴相关抗体和抗原供IVD厂家选用。百新意提供的抗体全部是人鼠嵌合抗体或人源化抗体,因此HAMA效应较低,更适合检测自身免疫疾病相关指标。
1、原料的选择
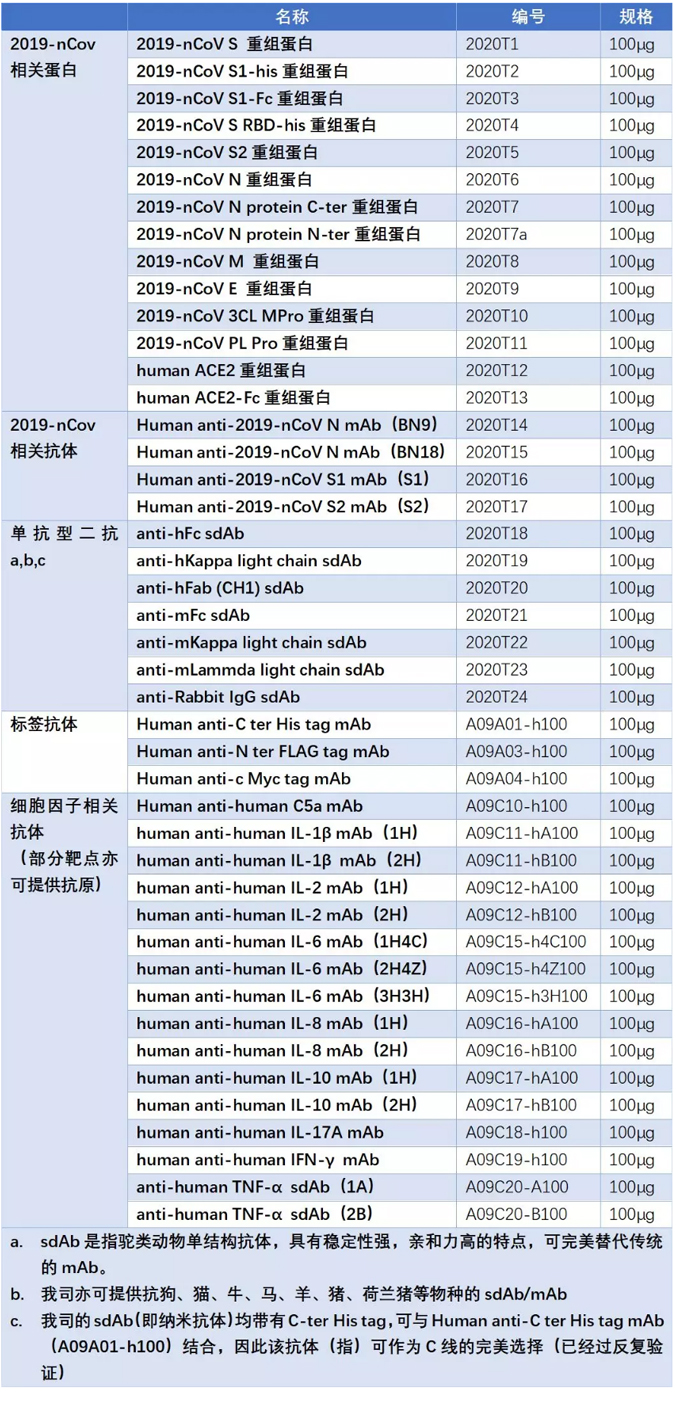
2019-nCoV是一类新发现的单股正链RNA冠状病毒2019-nCov,其基因组5’端有甲基化“帽”,3’端有polyA“尾”结构。冠状病毒,都有个显著的特征(图1),就是衣壳上长皇冠(crown),即Spike蛋白(简称S蛋白)。病毒基因组为连续线性单链RNA,直径在75-160nm。冠状病毒基因组依次编码棘突蛋白S(spikeprotein)、包膜蛋白E(envelopeprotein)、膜糖蛋白M(membraneglycoprotein)与核衣壳蛋白N(nucleocapsidprotein)。这么多种蛋白,到底哪些对于诊断的价值更高呢?下面我们就用最简洁的语言告诉您最关键的信息。
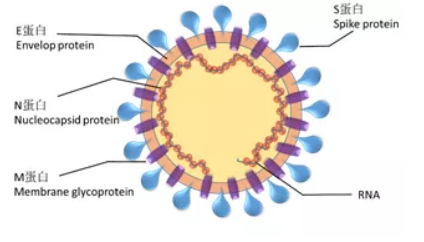
图1 2019-nCoV病毒颗粒示意图(A)
(1)S蛋白:诊断和治疗皆可
2019-nCoV和SARS-CoV的基因组都编码一个大棘突(Spike)蛋白(图2A)白可分为S1、S2和跨膜-膜内结构域。两种蛋白的S1结构域同源性较低,约68%。但S2结构域相当保守,序列一致性高达94%以上。其中S1上的受体结合结构域RBD负责与宿主细胞上的ACE2结合,两种病毒的S蛋白与ACE2的亲和力均在15nM左右(图2B)两种病毒的S蛋白同源性较高,因此推测2019-nCov的S蛋白与ACE2的结合介导了病毒的侵入。正式由于这一特性,针对S蛋白的治疗和诊断显得尤为重要。

图2 2019-nCovS蛋白结构模型(A)与2019-nCovSRBD-ACE2亲和力测定(B)
(2)N蛋白:诊断
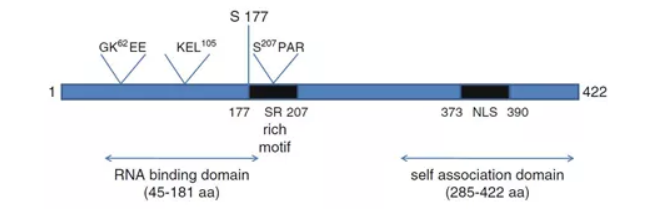
图3 SARS-CovN蛋白的结构示意图
N蛋白的N端与C端均可与病毒RNA结合,C端用于多聚化而形成高聚结构(图3)。比较SARS-CoV和2019-nCoV的N蛋白序列后发现,二者N蛋白相当的保守,序列一致性高达94%。有文献表明,SARS-CovN蛋白在病人感染的第二天即可在病人血浆中检测到,其抗体在感染7天后即可在30%以上病人血中检出。考虑到两种N蛋白的高同源性,因此推测N蛋白可作为2019-nCov早期筛查的一个重要指标。然而,需要注意的是,随着感染的进行,N蛋白在血液中含量将快速下降(图4A),此时可检测抗N或其他蛋白的抗体以防止漏检(图4B)。另有文献报道,SARS-CoV全长N蛋白会与感染其他冠状病毒的病人血清交叉反应,由于N蛋白的高同源性,推测2019-nCoVN蛋白亦可能有此现象,因此特异性可能会有一定问题。为了降低非特异,可选用截短的N蛋白。根据对SARS-CoV的文献调研,我们设计了两种截短的N蛋白(2020T7和2020T7a),理论上可在不降低灵敏度的前提下降低这种交叉反应。

图4 N蛋白、抗-N蛋白抗体在血中检出率随时间变化曲线
(3)M和E蛋白:辅助诊断,但特异性可能不够强
M蛋白是病毒颗粒中含量最多的蛋白,可保持病毒的完整形态,并与N蛋白相连接。E蛋白在病毒颗粒中含量不多,其功能与病毒组装及释放相关。通过文献调研,我们认为这两种蛋白单独作为2019-nCov的Biomarker并不十分合适,但可作为辅助检测指标以防止漏检。一个可能的应用是在检测抗S和抗N抗体的基础上,加测抗M和/或抗N抗体;亦可将S,N,M和E蛋白的若干多肽串联,做成嵌合多肽来检测抗体。
(4)受体——ACE2:可能可以用于夹心法
ACE2是近年来新发现的一种金属蛋白酶,属于Ⅰ型跨膜糖蛋白,具有羧肽酶活性,在调节心、肾功能以及控制血压中起关键作用。人类ACE2的细胞外区域由2个亚基组成,其中锌金属肽酶区域可以进一步分成2个亚域(Ⅰ和Ⅱ),形成一个长而深的裂缝,环绕裂缝顶端的隆起线带有很高的负电荷,这些负电荷与SARS-CoV/2019-nCoVS蛋白上RBD的正电荷互补(计算表明,2019-nCoVSRBD的pI为9.72,而ACE2的pI为5.67),从而与S蛋白RBD结合(图5)。由于2019-nCoVSRBD与ACE2的亲和力达到了15nM,因此也许可以将ACE2作为包被或检测用,与另一个非RBD结合表位的抗体组成检测对。
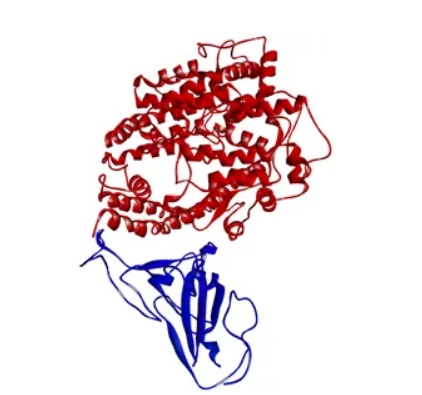
图5 2019-nCovSRBD与ACE2复合物结构模型
2、方法学的选择
(1)双抗原夹心检测抗体
优点:特异性可能比间接法高
缺点:抗原金标或酶标可能比较困难,可能稳定性不佳

(2)间接法检测抗体
优点:稳定性高,开发简单
缺点:特异性可能没有双抗原夹心法高

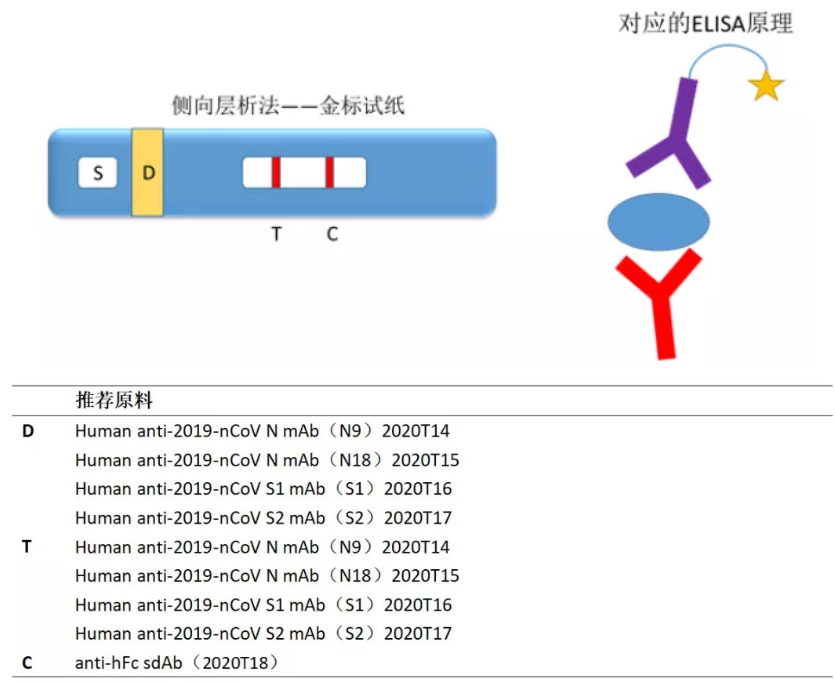
(3)双抗体或受体-抗体夹心检测抗原
优点:检测窗口更靠前,灵敏度高
缺点:高质量抗体难以短时间内开发出来
关键词:百新意 2019-nCoV病毒
分享至:
![]()
![]()




鄂公网安备 42011102004299号
© 2014-2024 前衍化学科技(武汉)有限公司 版权所有 鄂ICP备20009754号-1