癌症是一个主要的公共卫生问题,也是全球疾病负担的主要原因。国际癌症研究机构(IARC)估计,到2030年,仅人口的增长和老龄化预计将导致2170万新癌症病例和1300万癌症相关死亡。遗传因素,接触辐射和危险化学品,不健康的生活方式和其他风险因素继续增加未来人群的关于癌症方面的负担。
目前的化疗方案主要包括烷化剂,抗代谢物,抗生素,拓扑异构酶抑制剂和有丝分裂抑制剂,三十年来基本保持不变。抗癌药物不断在美国食品和药物管理局(FDA)药物批准名单中占主导地位,尽管2016年出现暂时下降。癌症药物发现的创新仍然是一项极具挑战性的工作。每年只有大约10种新的抗癌药物被FDA批准。新药开发的高成本和耗时性质是癌症药物发现的重大挑战。对68种随机选择的批准药物的分析估计,需要15年和8.02亿美元才能将新药推向市场。预审批总费用也以每年7.4%的速度增长。
开发新药的挑战表明需要探索治疗人类癌症的替代和新颖的可负担方法。将现有药物的适应症从一个治疗领域转换为包括治疗其他疾病的策略,也称为“药物再利用”或“药物重新定位”,根据现有的药物临床试验缩短了临床应用所需的时间结果和毒理学测试。这种新的药物发现方法与传统药物开发相比具有显着的优势。将已知药物和化合物用于新适应症可节省时间并降低将药物推向市场的成本。超过90%的药物未能通过开发过程。在过去几年中,越来越多的制药公司正在投入相当大的努力来提高药物重新定位的效率和成功率。这为基于已知药物的药物发现创造了新的策略。
精神病药物因其具有长期的临床使用历史和可耐受的安全性,并已被用作药物再利用的良好靶标。例如,硫利达嗪[5]已公认的抗微生物性质,它已经显示出对结核分枝杆菌的易感和多药耐药菌株的显着体外活性。由于不利的副作用,硫利哒嗪作为抗精神病药物的使用已经减少,但是研究和最近发现的其抗菌性能证明了其临床疗效的可行性和可靠性。可以进行更多研究以进一步阐明该药剂的其他潜在临床用途。还有许多其他例子,如氟哌啶醇及其衍生物溴哌啶醇,目前已被重新用于治疗各种真菌感染。
精神科药物作为新一代癌症化学疗法也很有前途。一些流行病学研究报告称,接受抗精神病药物治疗的精神分裂症患者的癌症发病率低于一般人群,这表明精神科药物可能对某些人类癌症产生积极影响。在接受精神分裂症药物的患者中观察到前列腺癌,结肠癌和直肠癌的发病率下降。此外,研究还表明,这些抗精神病药物可以在体外和体内诱导各种癌细胞的死亡。在这篇文章里,我们概述了各种用于癌症治疗的精神药物的再利用,并回顾了这些精神病药物的抗肿瘤作用的假定机制。此外,我们将讨论剩余的局限性和挑战,包括潜在的致癌性,有争议的临床研究以及一些精神药物的耐受性差。
精神科药物的抗肿瘤特性
开发新药的高成本和全球癌症负担日益严重,增加了人们对新型,负担得起的抗肿瘤药物的研究和开发的兴趣。精神病药物已经用于各种精神疾病数十年,并且目前据报道除了它们的抗精神病作用之外还具有针对多种恶性肿瘤的有效抗癌特性。
据报道,用第一代典型的抗精神病药物penfluridol治疗可通过诱导自噬介导的细胞凋亡来抑制胰腺肿瘤的生长。Wiklund等人发现匹莫齐特和非典型精神病药物奥氮平可破坏胆固醇的稳态,从而杀死癌细胞。还有许多具有抗肿瘤作用的神经活性药物的例子,包括抗抑郁药如选择性5-羟色胺再摄取抑制剂(SSRIs),三环类抗抑郁药和单胺氧化酶抑制剂(MAOIs)。戈登等人发现SSRIs 在活检样伯基特淋巴瘤细胞中直接诱导细胞凋亡相关的细胞毒性。在另一项研究中,帕罗西汀和舍曲林诱导剂量依赖性抑制人结肠癌细胞系和结直肠癌细胞异种移植小鼠的活力和增殖。三环类抗抑郁药被发现可抑制神经内分泌肿瘤的生长,包括小细胞肺癌,胰腺神经内分泌肿瘤和Merkel细胞癌。
这些数据表明,精神科药物可能具有临床治疗的抗肿瘤潜力。这些实验还有助于鉴定新的靶向策略,通过重新利用批准的药物,可以在患有各种肿瘤的患者中快速评估这些策略。具有潜在抗肿瘤作用的精神病药物总结于表1中。
表1 具有潜在抗肿瘤作用的精神病药物
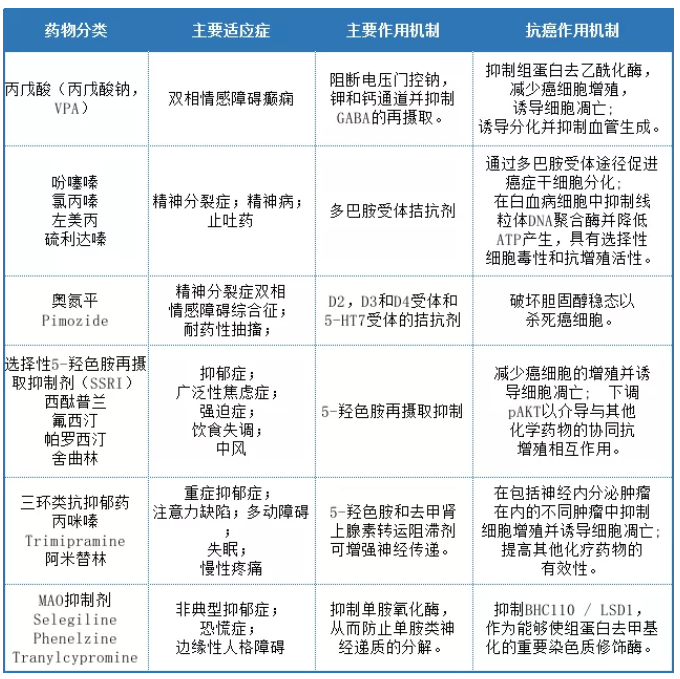
脑肿瘤的精神科药物
脑瘤几乎占每年在全世界诊断出的所有癌症相关死亡的2-3%。胶质母细胞瘤(GBM)是最常见的脑肿瘤,具有破坏性和极具攻击性的临床进展。该肿瘤的标准治疗包括手术切除,化疗和放疗。最近,在诸如化疗和新型免疫策略的脑癌的药物治疗中已经取得了重大突破。尽管已经做出了相当大的努力来提高效率,但这种破坏性疾病的临床改善仍然有限。
为了靶向大脑中的肿瘤,抗肿瘤药物必须能够自由地穿透血脑屏障(BBB)。大脑中全身给药的治疗药物的低药物浓度可能有助于脑肿瘤化疗的有限成功。该BBB限制了大多数化疗药物的递送。精神病药物已被证明具有抗各种癌症的抗肿瘤特性,这表明它们在治疗脑肿瘤方面具有潜力。这些药物已在临床环境中长期使用和研究,并可自由穿透大脑,这对脑肿瘤治疗非常重要。此外,精神科药物的化学机制和毒性已得到广泛研究,为新药开发节省了时间。
据最新文献报道报道,有几种精神药物对GBM有效。几十年来,丙戊酸一直被用作抗癫痫药物和情绪稳定剂。近年来,它还被发现抑制包括GBM在内的几种肿瘤细胞的生长。一些研究已经评估并证实这种药物有望用于GBM治疗。有研究表明,丙戊酸可以与常规疗法相结合,除了被识别为HDAC抑制剂,丙戊酸的抗GBM活性是通过分化和诱导介导的血管生成的抑制作用。另一种抗精神病药物匹莫齐特被发现到减少GBM细胞生长和干细胞存活。它被鉴定为USP 1特异性抑制剂,其抑制GMB干细胞发育和放射抗性。
抗精神病药物通过DR途径作用于人类癌症
癌症干细胞(CSC)假说已成为癌症治疗的重要里程碑。CSC与干细胞共享功能特征,包括增强的自我更新,迁移和存活能力,这有助于肿瘤异质性,治疗抗性和转移。CSCs促进肿瘤生长并抵抗分化,是一种罕见的细胞群。
选择性抑制CSC的化合物的鉴定可能是有希望的并且可用于临床前药物筛选。吩噻嗪类化合物包括氯丙嗪,左旋美丙嗪,异丙嗪,三氟拉嗪和硫利达嗪等抗精神药物类药物可抑制各种肿瘤细胞的增殖并诱导细胞凋亡,包括神经母细胞瘤,非小细胞肺癌,胶质瘤,黑色素瘤和白血病。在筛选了数百个小分子后,Sachlos等人发现抗精神病药物硫利达嗪,选择性地靶向CSCs。与其他化合物不同,硫利达嗪通过增强CSC分化而不是杀死它们起作用,表明硫利达嗪可用作选择性抗CSC剂。
为了评估甲硫哒嗪如何发挥其抗CSC活性,Sachlos等人[21]分析了DRs在正常和肿瘤性人多能干细胞(hPSCs)表面的表达,因为已知硫利达嗪是DR拮抗剂。他们发现所有DR都表达在白血病细胞表面,而不是正常的血液干细胞。该发现表明DRs表达可能在CSC中上调。该发现还表明DR途径可以作为某些CSC特异性的生物标志物,并且在临床治疗中具有前景。
精神病药物通过破坏胆固醇体内平衡来杀死癌细胞
胆固醇稳态是人体中受到最强烈调节的过程之一,已经被广泛研究100多年。胆固醇在各种过程中起着关键作用,属于动物细胞膜的重要组成部分,有助于细胞渗透性,亲和力和流动性,同时也是类固醇激素和胆汁酸的前体。胆固醇不足或过多可导致严重后果,包括动脉粥样硬化和代谢相关疾病。胆固醇代谢在跨膜信号传导过程和细胞生长中也起着关键作用。最近的一项研究表明,调节胆固醇和脂肪酸代谢的microRNA33可调节细胞增殖和周期进程。一项发表在癌症研究中的新研究表明,胆固醇稳态可能是前列腺癌治疗的新治疗靶点。
第一代抗精神病药物,被称为典型的精神药物,被认为通过阻断DR2发挥其抗精神病功效,导致锥体外系副作用和高催乳素血症。在20世纪90年代开发了第二代药物,如利培酮和奥氮平等非典型精神病药物。较新的精神药物具有更广泛的结合特征,影响DR以及血清素和组胺受体的活性。其治疗效果与不良代谢影响的风险相关,包括葡萄糖代谢受损,肥胖和血脂异常。研究发现,抗精神病药物可上调参与脂质体内平衡的基因。这些药物通过破坏细胞内运输和胆固醇的合成来上调脂肪生成基因的表达。在澳大利亚进行的一项研究:对抗精神病药(利血平,氯丙嗪,氟哌啶醇,匹莫齐特,利培酮和奥氮平)进行了筛选用于各种其潜在的抗癌作用的肿瘤细胞系衍生成淋巴细胞瘤,神经母细胞瘤,非小细胞肺癌,和乳腺癌。几乎所有这些药物都选择性地抑制癌细胞。此外,药物处理组的基因表达分析表明,奥氮平和匹莫齐特通过破坏胆固醇体内平衡发挥其细胞毒性。他们还发现,与胆固醇抑制剂美伐他汀共同给药可以减少这些精神科药物的副作用。这些结果表明,影响胆固醇体内平衡途径的精神病药物可能是用于癌症治疗的新型化学治疗剂。一些临床研究还发现,奥氮平防止化疗引起的恶心和呕吐。此外,研究报告称,奥氮平在给予患者后会在肺部积聚,这表明它可能在肺癌化疗中有前途。这些研究为未来抗癌药物使用精神药物提供了合理的基础,作为传统药物的替代策略。
精神病药物再利用的挑战和局限
一些研究证实了精神科药物对不同恶性肿瘤的抗癌作用。然而,在进一步临床应用之前需要考虑的这些药物的再利用中仍然存在挑战和限制。
临床使用的悠久历史,现有的药物临床结果和精神药物的毒理学使它们成为药物再利用的良好候选者。但是,长期服用精神科药物可能会导致副作用。服用第一代抗精神病药物的患者更容易出现锥体外系副作用,尤其是氟哌啶醇,zotepine和氯丙嗪。体重增加和相关代谢性疾病已被识别为具有第二代抗精神病药物。精神病药物的其他副作用,如QTc延长,催乳素增加,性功能障碍,镇静,体位性低血压和心律失常对患者来说也是比较不合适的。与长期精神病药物相关的另一个重要问题是耐受性发作,应始终在服用精神病药物的患者中进行评估。由于交叉耐受性问题,之前的精神科药物可能会影响新药使用的效率,这部分解释了为什么新的临床试验不成功。与一般精神病药物相关的耐受性发作相对较低且可接受。Wheler等人发现当与贝伐单抗合用时(11mg / kg静脉注射[IV]每14天一次),丙戊酸(5.3mg / kg口服[PO]每日)在治疗晚期癌症患者中是安全且耐受良好的。然而,还应监测高剂量诱导的神经毒性。在以前的研究中,高剂量的报道丙戊酸与几个神经毒性(患者20-26%),包括疲劳,精神错乱,和相关联的嗜睡。必须考虑所有这些因素,并需要进一步研究以平衡其他临床应用的效益/风险比。
结论
面对高成本和药物开发的风险,研究人员目前正集中精力重新利用现有药物,包括临床试验失败的药物。最成功的药物再利用案例之一是西地那非。在西地那非治疗心血管疾病的1期试验中观察到阴茎勃起后,对勃起功能障碍治疗进行了重新评估。重新利用药物有助于改造旧药物以获得新的适应症,使用已知毒性和药理学的药物使药物开发更具可预测性。它还帮助医生处理标签上和标签外的药物处方。已经发现许多药物对于他们之前未被批准治疗的适应症是有效的。药物再利用为在进一步试验中研究观察到的作用的机制提供了机会。这可能是一个有希望的补充,以及一个更有效和相对快速的新药发现战略。
在这篇文章中,简要分析了抗精神病药物的显着抗肿瘤特性,包括丙戊酸,吩噻嗪,奥氮平,匹莫齐特,抗抑郁药和其他针对各种肿瘤的精神科药物。这些药物已被证明可以在临床前研究中阻止癌细胞增殖并诱导其凋亡,但需要进一步研究以阐明这些精神药物药物的确切机制和靶点。此外,还有许多药物,包括丙戊酸和硫利达嗪,目前正在临床试验中进行评估。这些发现对于产生新的化学治疗药物非常有希望。
尽管有上述发现,但仍有一些关注使用精神病药物治疗癌症化疗。发现使用一些精神药物可以降低患癌症的风险。SSRIs 被认为可以抑制结肠癌细胞的生长,并且可以用于化学预防目的。增加实验和流行病学数据已经证明,精神科药物的抗多巴胺活性可能导致潜在的高催乳素血症。在癌症治疗中使用精神病药物的另一个问题是它们可能的,意外的和频繁的副作用。虽然精神病学的疗程已经在临床上使用数年,它们被已知诱导范围广泛的不利影响。常见的不良反应是锥体外系综合征,体位性低血压,心律失常和代谢综合征。需要进一步调查以评估确切的机制,效率和不利影响。
参考文献
1.R.L.Siegel,K.D.Miller,A.JemalCancer statistics, 2016CA A Cancer J. Clin., 66 (2016), pp. 7-30
2.K.SakChemotherapy and dietary phytochemical agentsChemother.Res.Pract., 2012 (2012), p. 282570
3.A. Mullard2016 FDA drug approvals, Nature reviewsDrug Discov., 16 (2017), pp. 73-76
4.A. Mullard2015 FDA drug approvals, Nature reviewsDrug Discov., 15 (2016), pp. 73-76
5.J.A. DiMasi, R.W. Hansen, H.G. GrabowskiThe price of innovation: new estimates of drug development costsJ. Health Econ., 22 (2003), pp. 151-185
6.L. Amaral, M. Viveiros, J.E. KristiansenNon-Antibiotics": alternative therapy for the management of MDRTB and MRSA in economically disadvantaged countries
7.D. Ordway, M. Viveiros, C. Leandro, R. Bettencourt, J. Almeida, M. Martins, J.E. Kristiansen, J. Molnar, L. AmaralClinical concentrations of thioridazine kill intracellular multidrug-resistant Mycobacterium tuberculosisAntimicrob. Agents Chemother., 47 (2003), pp. 917-922
8.D. Ordway, M. Viveiros, C. Leandro, M.J. Arroz, L. AmaralIntracellular activity of clinical concentrations of phenothiazines including thioridiazine against phagocytosed Staphylococcus aureusInt. J. Antimicrob. Agents, 20 (2002), pp. 34-43
9.M.M. Kristiansen, C. Leandro, D. Ordway, M. Martins, M. Viveiros, T. Pacheco, J.E. Kristiansen, L. AmaralPhenothiazines alter resistance of methicillin-resistant strains of Staphylococcus aureus (MRSA) to oxacillin in vitroInt. J. Antimicrob. Agents, 22 (2003), pp. 250-253
10.S.Y.L. Holbrook, A. Garzan, E.K. Dennis, S.K. Shrestha, S. Garneau-Tsodikova
Repurposing antipsychotic drugs into antifungal agents: synergistic combinations of azoles and bromperidol derivatives in the treatment of various fungal infections
Eur. J. Med. Chem., 139 (2017), pp. 12-21
11.P.B. MortensenThe incidence of cancer in schizophrenic patientsJ. Epidemiol. Community Health, 43 (1989), pp. 43-47
12.P.B. MortensenNeuroleptic medication and reduced risk of prostate cancer in schizophrenic patientsActaPsychiatr. Scand., 85 (1992), pp. 390-393
13.D. Lichtermann, J. Ekelund, E. Pukkala, A. Tanskanen, J. LonnqvistIncidence of cancer among persons with schizophrenia and their relativesArch. Gen. Psychiatr., 58 (2001), pp. 573-578
14.S.O. Dalton, L. Mellemkjaer, L. Thomassen, P.B. Mortensen, C. JohansenRisk for cancer in a cohort of patients hospitalized for schizophrenia in Denmark, 1969-1993
Schizophr. Res., 75 (2005), pp. 315-324
15.G. Spengler, A. Csonka, J. Molnar, L. AmaralThe anticancer activity of the old neuroleptic phenothiazine-type drug thioridazineAnticancer Res., 36 (2016), pp. 5701-5706
16. J.J. Chen, N. Cai, G.Z. Chen, C.C. Jia, D.B. Qiu, C. Du, W. Liu, Y. Yang, Z.J. Long, Q. ZhangThe neuroleptic drug pimozide inhibits stem-like cell maintenance and tumorigenicity in hepatocellular carcinomaOncotarget, 8 (2017), pp. 17593-17609
17. H. Li, J. Li, X. Yu, H. Zheng, X. Sun, Y. Lu, Y. Zhang, C. Li, X. BiThe incidence rate of cancer in patients with schizophrenia: a meta-analysis of cohort studiesSchizophr. Res. (2017)
18.S.S. Tworoger, S.E. HankinsonProlactin and breast cancer riskCancer Lett., 243 (2006), pp. 160-169
19.E. Sachlos, R.M. Risueno, S. Laronde, Z. Shapovalova, J.H. Lee, J. Russell, M. Malig, J.D. McNicol, A. Fiebig-Comyn, M. Graham, M. Levadoux-Martin, J.B. Lee, A.O. Giacomelli, J.A. Hassell, D. Fischer-Russell, M.R. Trus, R. Foley, B. Leber, A. Xenocostas, E.D. Brown, T.J. Collins, M. BhatiaIdentification of drugs including a dopamine receptor antagonist that selectively target cancer stem cellsCell, 149 (2012), pp. 1284-1297
20. I. Gil-Ad, B. Shtaif, Y. Levkovitz, M. Dayag, E. Zeldich,A.WeizmanCharacterization of phenothiazine-induced apoptosis in neuroblastoma and glioma cell lines: clinical relevance and possible application for brain-derived tumorsJ. Mol. Neurosci., 22 (2004), pp. 189-198
21. J. Mu, H. Xu, Y. Yang, W. Huang, J. Xiao, M. Li, Z. Tan, Q. Ding, L. Zhang, J. Lu, X. Wu, Y. LiuThioridazine, an antipsychotic drug, elicits potent antitumor effects in gastric cancerOncol. Rep., 31 (2014), pp. 2107-2114
22. E.D. Wiklund, V.S. Catts, S.V. Catts, T.F. Ng, N.J. Whitaker, A.J. Brown, L.H. Lutze-MannCytotoxic effects of antipsychotic drugs implicate cholesterol homeostasis as a novel chemotherapeutic targetInt. J. Cancer, 126 (2010), pp. 28-40
23.I. Gil-Ad, A. Zolokov, L. Lomnitski, M. Taler, M. Bar, D. Luria, E. Ram, A. WeizmanEvaluation of the potential anti-cancer activity of the antidepressant sertraline in human colon cancer cell lines and in colorectal cancer-xenografted mice
Int. J. Oncol., 33 (2008), pp. 277-286
24.N.S. Jahchan, J.T. Dudley, P.K. Mazur, N. Flores, D. Yang, A. Palmerton, A.F. Zmoos, D. Vaka, K.Q. Tran, M. Zhou, K. Krasinska, J.W. Riess, J.W. Neal, P. Khatri, K.S. Park, A.J. Butte, J. SageA drug repositioning approach identifies tricyclic antidepressants as inhibitors of small cell lung cancer and other neuroendocrine tumorsCancer Discov., 3 (2013), pp. 1364-1377
25.D. Willmann, S. Lim, S. Wetzel, E. Metzger, A. Jandausch, W. Wilk, M. Jung, I. Forne, A. Imhof, A. Janzer, J. Kirfel, H. Waldmann, R. Schule, R. BuettnerImpairment of prostate cancer cell growth by a selective and reversible lysine-specific demethylase 1 inhibitorInt. J. Cancer, 131 (2012), pp. 2704-2709
26.J. Ding, Z.M. Zhang, Y. Xia, G.Q. Liao, Y. Pan, S. Liu, Y. Zhang, Z.S. Yan
LSD1-mediated epigenetic modification contributes to proliferation and metastasis of colon cancerBr. J. Cancer, 109 (2013), pp. 994-1003
27. J. Huang, F. Liu, H. Tang, H. Wu, L. Li, R. Wu, J. Zhao, Y. Wu, Z. Liu, J. Chen
Tranylcypromine causes neurotoxicity and represses BHC110/LSD1 in human-induced pluripotent stem cell-derived cerebral organoids modelFront. Neurol., 8 (2017), p. 626
28.D.A. Reardon, G. Freeman, C. Wu, E.A. Chiocca, K.W. Wucherpfennig, P.Y. Wen,E.F. Fritsch, W.T.Curry Jr.,J.H.Sampson,G. DranoffImmunotherapy advances for glioblastomaNeuroOncol., 16 (2014), pp. 1441-1458
29. J.A. Driver, G. Logroscino, J.E.Buring, J.M. Gaziano, T. KurthA prospective cohort study of cancer incidence following the diagnosis of Parkinson's diseaseCancer Epidemiol. Biomark. Prev., 16 (2007), pp. 1260-1265
30. J. Huang, C. Zeng, J. Xiao, D. Zhao, H. Tang, H. Wu, J. ChenAssociation between depression and brain tumor: a systematic review and meta-analysisOncotarget, 8 (55) (2017)
关键词:精神科药物 抗癌药物
分享至:
![]()
![]()




鄂公网安备 42011102004299号
© 2014-2025 前衍化学科技(武汉)有限公司 版权所有 鄂ICP备20009754号-1