据哈佛大学(Harvard University)的提供的消息,哈佛大学化学和化学生物学系名誉化学教授岸义人(Yoshito Kishi)说:“我们花了几十年时间进行基础研究,取得了非常显著的进展。”这就是一个酝酿了30年的壮举: 岸义人领导的哈佛大学的化学家们已经完成了一篇新论文,在其中所称是“药物发现的里程碑”,该论文论述了哈利洪德林(halichondrin)的全合成。哈利洪德林在小鼠研究中被认为是一种有效的抗癌剂,并在天然的海绵体中发现——尽管含有量很少——哈利洪德林类(halichondrins)分子结构极其复杂,从未在实验室中大规模合成过。
岸义人是哈佛大学化学与化学生物学系莫里斯·勒布(Morris Loeb)的名誉化学教授,已经完成了有足够数量的E7130合成。E7130也是属于从海绵体中提取的哈利洪德林类化合物中的一种,具有潜在抗肿瘤活性。经静脉滴注后,E7130可与微管蛋白vinca结构域结合,抑制微管蛋白聚合和微管组装,从而抑制有丝分裂纺锤体组装,诱导细胞周期阻滞在G2/M期。为了严格的研究其生物活性、药理特性和有效性,与日本卫材制药公司(Japanese pharmaceutical company Eisai)的研究人员进行合作。此分子已经经历了异常快速的发展,并已在日本进行了一期临床试验,由哈佛大学技术开发办公室(Harvard's Office of Technology Development,OTD)授权给卫材(Eisai)制药公司。该公司希望在适当的时候在美国开始第二次临床试验。
岸义人实验室的研究成果,通过与卫材长达三年的紧密合作,于2019年6月17日发表在开放获取的自然杂志社出版的《科学报告》(Scientific Reports)上——Satoshi Kawano, Ken Ito, Kenzo Yahata, Kazunobu Kira, Takanori Abe, Tsuyoshi Akagi, Makoto Asano, Kentaro Iso, Yuki Sato, Fumiyoshi Matsuura, Isao Ohashi, Yasunobu Matsumoto, Minetaka Isomura, Takeo Sasaki, Takashi Fukuyama, Yusuke Miyashita, Yosuke Kaburagi, Akira Yokoi, Osamu Asano,Takashi Owa, Yoshito Kishi. A landmark in drug discovery based on complex natural product synthesis. Scientific Reports, 2019, 9, Article number: 8656.DOI: 10.1038/s41598-019-45001-9。
本文报道了高效哈利洪德林类化合物E7130(halichondrin molecule E7130) 的全合成,并已经制得E7130分子11.5 g,其纯度为99.81%,并对其作用模式进行了表征。在临床前研究中,研究小组已经确定它不仅是一种微管动力学抑制剂,正如之前所认识的,而且是一种新的靶向肿瘤微环境的药物。
岸义人说:“我们花了几十年的时间进行基础研究,如今取得了巨大的进步。”自1978年以来,岸义人的实验室一直得到美国国立卫生研究院(National Institutes of Health,NIH)下属的美国国家癌症研究所(National Cancer Institute, NCI)的大力支持,以天然产物的合成作为研究目标。
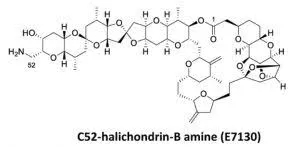
通过全合成得到的完整的E7130分子的结构尤其难以复制,因为它有31个手性中心,每个不对称点必须正确定位。换句话说,要想得到它有大约40亿种方法会出错。
33年前,当日本研究人员首次发现这种天然产物时,立即引起了人们的兴趣。卫材肿瘤业务集团的首席医药创意官和首席发现官、论文作者之一大和田孝(Takashi Owa)博士回忆说:“当时,他们意识到,哈利洪德林类化合物(halichondrins)看起来非常有效。”但是,随着时间的推移,NCI的研究人员测试了少量的它,认识到它正在影响微管的形成,这是细胞分裂必不可少的。大和田孝博士解释说:“由于这种天然产物的独特结构,许多人对这种行为模式很感兴趣,研究人员想做一项临床研究,但药物供应不足成为进行临床研究的拦路虎。”因此,一拖30年过去了,非常不幸,但岸义人教授是这一领域的先驱。”
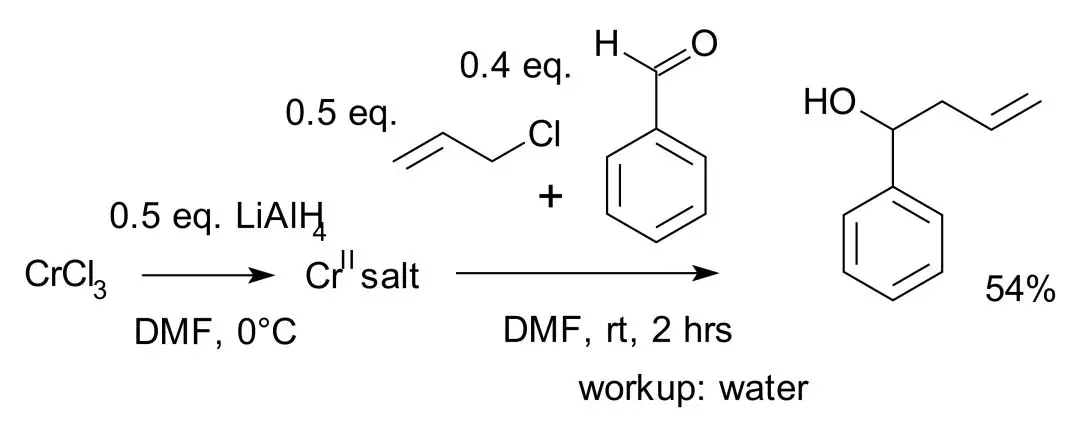
多年来,岸义人实验室采用了先进的聚集合成(convergent synthesis)方法,使复杂分子能够从亚单位(subunits)组装而成,而并非线性构建。另一个创新,现在被称为野崎-桧山-岸反应(Nozaki-Hiyama-Kishi reaction,简称“NHK反应”)是由镍或铬介导的烯丙基或乙烯基卤与醛偶联为醇的反应。该反应的反应形式与Barbier 反应相同,保护高反应性官能团的组装。
该反应系高井和彦、野崎一(Hitosi Nozaki)和桧山为次郎(Tamejiro Hiyama)在1977年报道,其最早发现的为铬(Ⅱ)催化的苯甲醛与烯丙基氯间的偶联,其中铬(Ⅱ)盐由氯化铬(Ⅲ)与氢化铝锂作用制得。
1983年反应适用范围被拓展至以乙烯基卤、三氟甲磺酸酯和芳基碘化物或溴化物作为底物。研究发现反应效果与氯化铬(Ⅱ)的来源有很大关系。1986年,高井和彦等人发现了氯化铬(Ⅱ)中的镍杂质对碳铬键形成有明显的促进作用,从而发现镍对反应的共催化作用。
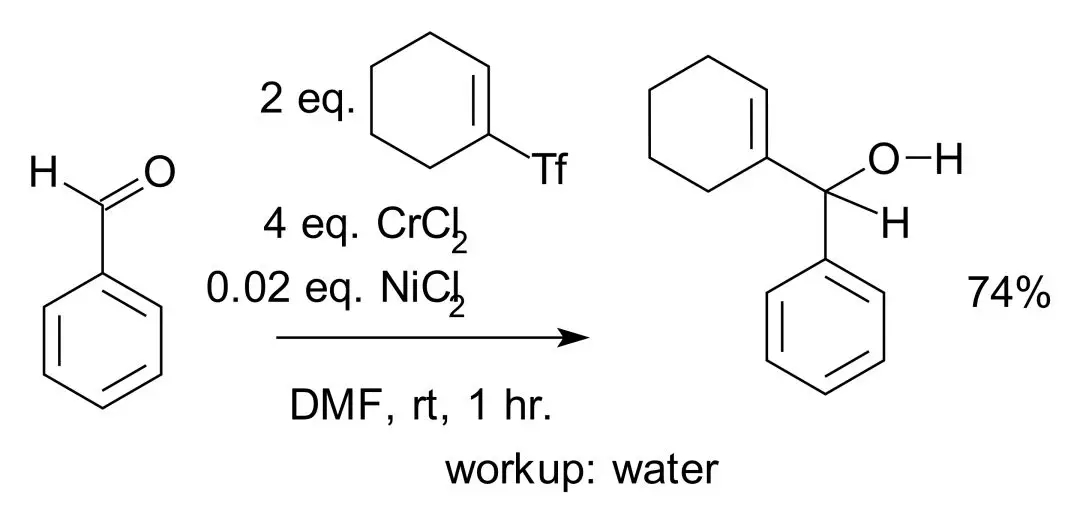
同年,岸义人(Yoshito Kishi)等在合成沙海葵毒素(palytoxin)时,也分别发现镍的催化作用。
1992年,岸义人和他的同事完成了第一个哈利洪德林(halichondrin)分子(halichondrin B)的全合成,该过程需要100多个化学反应序列,总收率不足1%。然而,这是一项重大成就,而这种分子的简化版本——艾瑞布林(eribulin)——成为了一种治疗转移性乳腺癌和脂肪肉瘤的药物,目前由日本卫材药业上市销售。从那以后,岸义人的实验室一直从事有机合成的基础研究,包括发现和开发在合成后期可用的新反应。
岸义人说:“1992年,合成一克重的海参碱是不可想象的,但三年前,我们向卫材药业提出了这个想法。有机合成已经发展到另一个水平,即使分子的复杂性在几年前是不可企及的。我们很高兴看到我们的基本化学发现,现在使大规模合成这种化合物成为可能。”
大和田孝说:“这是全合成方面一个前所未有的成就,也是一个特殊的成就。“没有人能够在10g范围内生产出哈利洪德林类(halichondrins)化合物1mg,仅此而已。他们已经完成了惊人的全合成,使我们能够启动E7130的临床试验。”
该团队的科学报告论文描述了在动物模型中进行的体外和体内研究的结果,阐明了分子的复杂作用模式。研究小组发现E7130可以增加肿瘤内CD31阳性内皮细胞(intratumoral CD31-positive endothelial cells),减少肿瘤微环境中可能参与肿瘤向恶性转化的α- SMA阳性成纤维细胞(alpha-SMA-positive cancer-associated fibroblasts)。
大和田孝说:“岸义人教授的专业知识为我们提供了这样一个令人兴奋和独特的机会,来测试我们系统中的分子。”“我从未经历过这种高效、快速、成功的合作。仅仅三年的合作就把这种复杂分子从发现阶段带到了临床开发阶段,并具有非常独特的机制和作用模式。对我来说,这是一种药物研发的创新记录。”
“卫材和哈佛大学的科学家之间的合作是学术界和产业界共同努力的一个例子,他们成功地加速了一种新疗法的开发,这种疗法可能会解决一些重要的尚未得到满足的医疗需求,”哈佛大学OTD战略伙伴关系董事总经理薇薇安•柏林(Vivian Berlin)表示,“这种合作精神和透明的关系对项目的成功做出了巨大的贡献。”
大和田孝补充说:“没有OTD,这种合作永远不会发生。哈佛OTD一直是连接业界和哈佛研究人员的核心,并促成有关如何建立双赢关系展开讨论。”更多信息请注意浏览原文或者相关报道。
关键词:化学合成 抗癌药
分享至:
![]()
![]()




鄂公网安备 42011102004299号
© 2014-2024 前衍化学科技(武汉)有限公司 版权所有 鄂ICP备20009754号-1